¿Qué es el enlace químico? Hace referencia a la unificación de átomos y moléculas para crear un compuesto químico muy complejo y con alta permanencia en un estado. En este proceso se pueden cambiar las características físicas y químicas de los átomos y las moléculas para formar sustancias homogéneas que no se puedan separar por ningún mecanismo físico.
Este tipo de enlace surge en la naturaleza y eso hace que forme parte de los elementos inorgánicos y de las distintas formas de vida, por ejemplo, las proteínas y los aminoácidos esenciales, ramificados y naturales son los pilares fundamentales de la vida.
Dos de los enlaces químicos son el iónico y el covalente. ¿Quieres saber cuáles son las diferencias entre ambos? Sigue leyendo ya que a continuación se explican detalladamente.
Diferencia en el concepto
Definición del enlace covalente
Este tipo de enlace surge entre elementos con una electronegatividad distinta, esto provoca que el átomo menos electronegativo (no metal) pase al más electronegativo (metal) electrones. Esto sucede entre elementos que están totalmente alejados en la tabla periódica, más concretamente, se encuentran en un extremo y en el otro.
Definición del enlace covalente
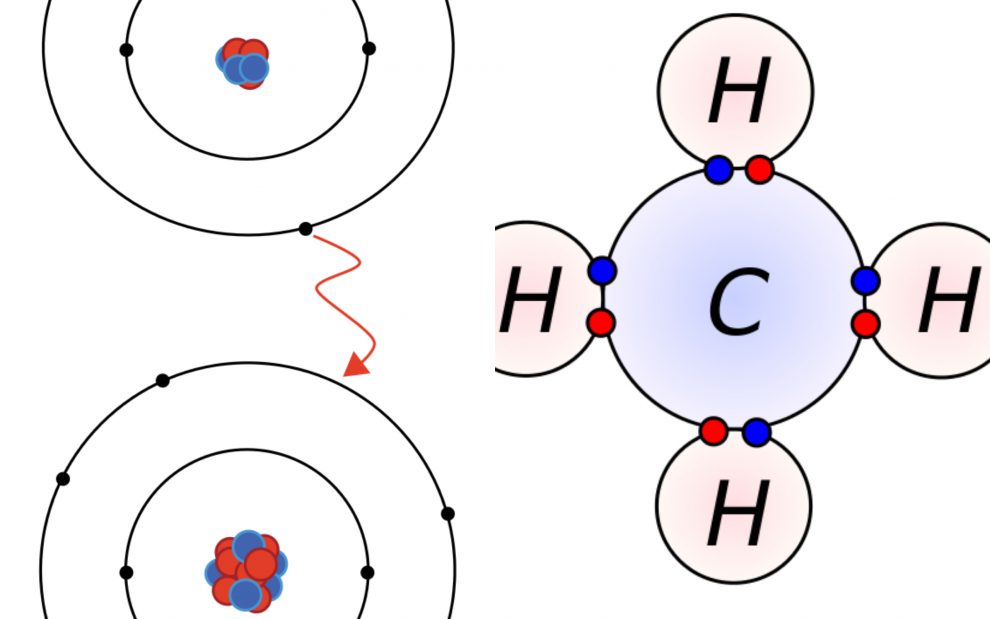
Este tipo de enlace surge entre elementos con una electronegatividad elevada, por eso lo que hacen los dos átomos es compartir electrones para completar la regla del octeto. Cada dos electrones que se reparten se crea un enlace y debe ser entre elementos no metales.
Diferencias generales
| El enlace iónico | El enlace covalente |
| A temperatura ambiente se encuentra en un estado sólido | A temperatura ambiente es capaz de estar en estado sólido (blando), líquido y gaseoso |
| El punto de fusión y de ebullición es muy elevado | La temperatura de ebullición y de fusión es muy baja |
| Es soluble en agua en cualquier ambiente | Molécula polar: soluble en disolvente polar
Molécula apolar: solubles en disolvente apolar |
| Conduce la electricidad cuando se encuentra disuelto en agua | Actúa como aislante de la corriente eléctrica y el calor |
Diferencia en el sustento de la unión
En el enlace iónico la unión se sustenta por la atracción que hay entre las cargas negativas que se crean, o más bien, por la atracción que hay entre los aniones y los cationes. Mientras que en el enlace covalente el sustento de la unión deriva de la fuerza de atracción que surge entre las cargas positivas de los núcleos y las cargas negativas de los electrones.
Diferencia en los electrones
La diferencia más destacable entre el enlace iónico y el covalente es que el primero se trata de ganar o perder electrones mientras que el segundo se centra en compartir los electrones.
En el enlace iónico el elemento metal pierde un electrón y el elemento no metal lo gana, una forma de intercambiar o traspasar energía al tener cargas opuestas que hace que se aproximen. En el enlace covalente el punto clave es compartir electrones para crear moléculas con mucha estabilidad, eso sí, sin realizar ningún intercambio.